近日,我所张伟教授团队连续在国际权威期刊《Cell reports Medicine》(IF=10.6)和《Signal Transduction and Targeted Therapy》(IF=52.7)发表“共生微生物与免疫检查点抑制剂个体化用药”方向系列研究成果。
《Cell reports Medicine》上发表题为“Identification and validation of intratumoral microbiome associated with sensitization to immune checkpoint inhibitors”的论著,中南大学信息与网络中心高性能计算中心邹有主任为本文共同通讯作者,湘雅医院临床药理研究所2024级博士研究生陈俊宏为独立第一作者;在《Signal Transduction and Targeted Therapy》上发表题为“Single-cell transcriptomic analysis reveals gut microbiota-immunotherapy synergy through modulating tumor microenvironment”的论著。四川大学许恒和张彦教授为该文共同通讯作者,四川大学博士曹珉渊、邓纭、郝青、鄢画云及湘雅医院临床药理研究所2022级硕士王泉林为共同第一作者。
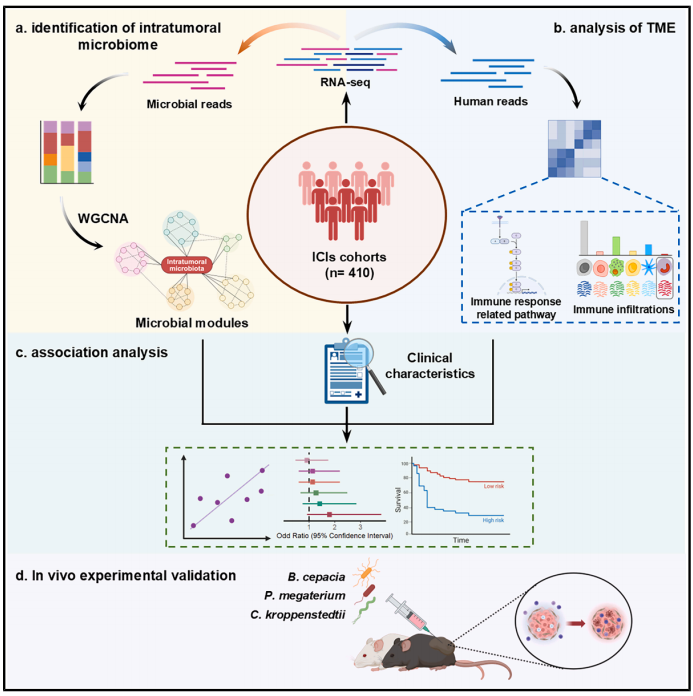
微生物群可能通过黏膜破坏、从邻近组织迁移或血源性入侵等途径在肿瘤组织中定植。已有研究指出,瘤内微生物与肿瘤的发生发展以及化疗疗效密切相关,且同样可以通过调节肿瘤微环境(TME)从而影响抗肿瘤免疫。然而,由于低丰度和纯净样本不易获取等问题,瘤内微生物的鉴定与分析难度较大,其与ICIs临床疗效之间的关系仍不明确。

张伟教授团队联合邹有主任和刘荣副研究员共同搭建生物信息学分析管道,从ICIs治疗队列的RNA-seq中成功提取出纯净的瘤内微生物信息。利用网络分析等方法对瘤内微生物数据进行降维处理,鉴别与ICIs疗效、生存预后以及TME特征关联的瘤内微生物。从分析结果筛选出的Burkholderia cepacia、Priestia megaterium和Corynebacterium kroppenstedtii分别在黑色素瘤内定植均可显著增强PD-1单抗对荷瘤小鼠的治疗作用。结合多色流式细胞术与RNA-seq分析,发现三种细菌显著增加CD8+T细胞的瘤内浸润,此外B. cepacia还增加了IFNγ+CD8+T与NK细胞的比例,而C. kroppenstedtii偏向于激活免疫刺激型巨噬细胞,P. megaterium则显著提升了CD8+T对肿瘤的识别能力。该研究为瘤内微生物影响患者对ICIs的应答提供了依据,从瘤内微生物层面上为提高ICIs抗癌疗效提供了新思路。
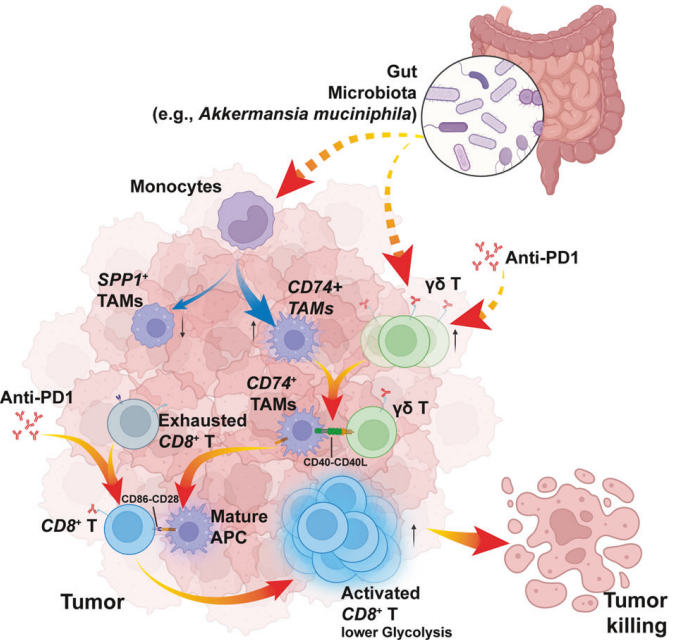
作为共生微生物最大的组成部分——肠道微生物已被证明与免疫治疗密切相关。临床和临床前研究表明,抗生素介导的肠道微生物耗竭会减少患者和小鼠模型的ICIs反应,而特定的肠道菌株或肠道菌代谢物的回补都可以提高基于ICIs的疗法的反应率和疗效,表明ICIs和肠道微生物群在免疫治疗中具有潜在的协同作用。然而,在ICIs治疗背景下,完整肠道微生物群对TME的具体调节作用仍不清楚。

本研究中采用小鼠皮下瘤模型结合单细胞转录组测序与多重免疫荧光来剖析肠道微生物群与ICIs对TME的协同作用。研究结果证明完整的肠道微生物群可以诱导M1型CD74+肿瘤相关巨噬细胞(TAMs)生成,抑制M2型SPP1+促肿瘤TAMs;扩增效应记忆CD8+T细胞,抑制终末耗竭;还可以提升γδ T细胞表面的CD40lg表达,通过γδ T细胞-APC-CD8+ T细胞轴激活免疫反应。此外,巨噬细胞中Spp1的条件敲除消除了微生物群对ICls反应的依赖性,将SPP1+TAMs确定为微生物群介导TME重塑的关键靶标。该研究揭示了肠道微生物群与ICIs联合治疗的协同机制,为调节肠道微生物组克服ICls耐药的思路提供了合理的策略。